2021年3月24日,清华大学免疫学研究所林欣教授团队在 Science 子刊 Science Translational Medicine 杂志上发表题为:Chimeric STAR receptors using TCR machinery mediate robust responses against solid tumors 的研究论文。
研究团队设计并构建了一种新型嵌合受体,命名为合成T细胞受体抗原受体(Synthetic T cell receptor and Antigen Receptor,STAR),这种新型嵌合STAR受体T细胞在多种实体肿瘤模型中获得优于传统CAR-T细胞的疗效,该研究还揭示了其背后的机制。
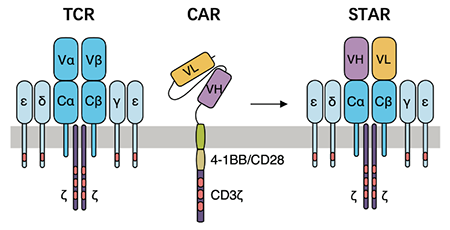
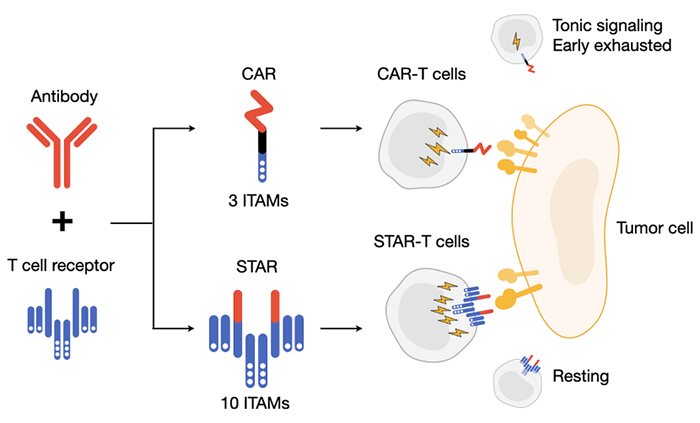
STAR是通过将抗体轻链和重链可变区与T细胞受体的α和β链恒定区相融合而得的双链结构(图1);其α、β链会与T细胞内源性的CD3亚基结合形成复合体。STAR兼具抗体特异性识别抗原的特点以及类似天然TCR的信号转导能力。体外功能实验结果显示,STAR-T细胞展现出和CD28-CAR-T细胞相当的特异性杀伤功能,同时还保持了和4-1BB-CAR-T细胞一样的存活和增殖能力。在上皮细胞癌、脑胶质母细胞瘤和肝癌的动物模型中,STAR-T细胞展现出优于传统CAR-T细胞的抗肿瘤效果,并且无明显的毒副作用。进一步的机制研究表明,STAR-T细胞的激活信号具有强度高和抗原敏感性高的特点。此外,STAR受体的信号转导过程和导致的基因表达模式与天然的T细胞受体(TCR)具有高度相似性,而与CAR存在着较大差异。此外,研究结果显示,STAR-T细胞和TCR-T细胞无自激活现象,而多种CAR-T细胞均存在较严重的自激活情况,持续的激活使CAR-T细胞更早发生耗竭。最后,研究者进一步揭示了STAR的构造框架可以兼容多种功能结构域,因此可以根据治疗需要来定制多种功能的STAR-T细胞,包括靶向双靶点、提供共刺激因子信号或增殖信号等。上述STAR-T细胞所具备的良好性质使其成为治疗实体肿瘤的新希望。同时,本文的研究成果为嵌合受体的设计和临床应用提供了理论依据和实践经验,并且加深了对T细胞信号转导机制和功能调控的理解。STAR-T细胞相比传统CAR-T细胞而言,具有激活强度高、抗原敏感性高的特点,并且不产生自激活信号导致的T细胞耗竭清华大学生命科学联合中心博士毕业生刘玥为本文的第一作者,清华大学医学院博士生刘光娜、生命科学联合中心博士后王嘉盛为共同第一作者,清华大学医学院博士生郑哲宇为本研究作出重要贡献,林欣教授和赵学强副研究员为本文的共同通讯作者,本项目的研究受到了国家自然科学基金委、科技部重点研发项目、北京市科委、清华大学-北京大学生命科学联合中心、结构生物学高精尖创新中心等多个项目的支持。https://stm.sciencemag.org/content/13/586/eabb5191